チオアセタール(thioacetal)はアセタールの硫黄アナログである。モノチオアセタールとジチオアセタールの2種類がある。モノチオアセタールはまれであり、官能基RC(OR')(SR")Hを持つ。ジチオアセタールはさらに、化学式 RC(SR')2H(対称ジチオアセタール)および RC(SR')(SR")H(非対称ジチオアセタール)に分類される。
対称ジチオアセタールが比較的よく見られる。これらはアルデヒドとチオールまたはジチオールとの縮合によって調製される。これらの反応はヘミチオアセタール中間体を経て進行する。
- チオールの付加によりヘミチオアセタールができる:
- チオールの付加と水が遊離することでジチオアセタールができる:
このような反応は一般的に触媒としてルイス酸またはブレンステッド酸を使用する。
アルデヒドと1,2-エタンジチオールまたは1,3-プロパンジチオールから生成されたジチオアセタールは有機合成で利用するためのこの種の分子としては特に一般的である。
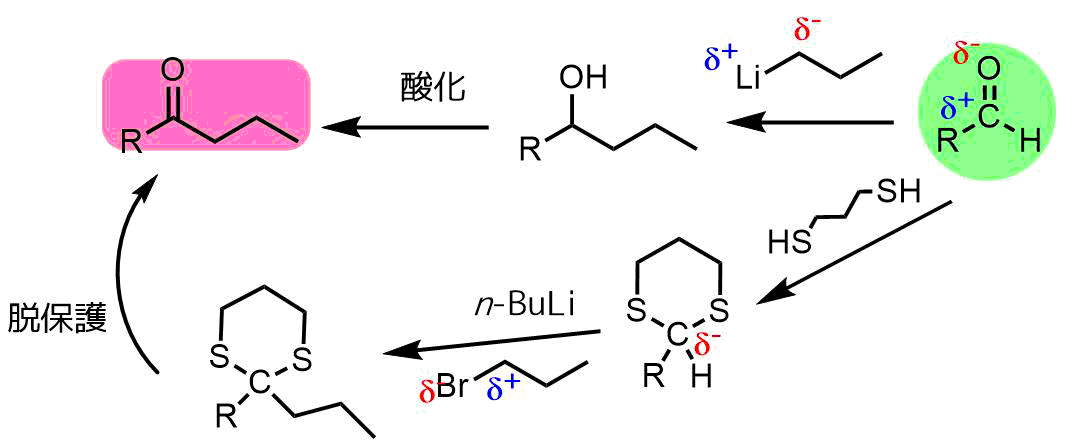
アルデヒドのカルボニル炭素は求電子性であり、ゆえに求核剤による攻撃を受けやすいが、ジチオアセタールの類似の中心炭素は求電子性ではない。結果として、ジチオアセタールはアルデヒドの保護基として使うことができる。
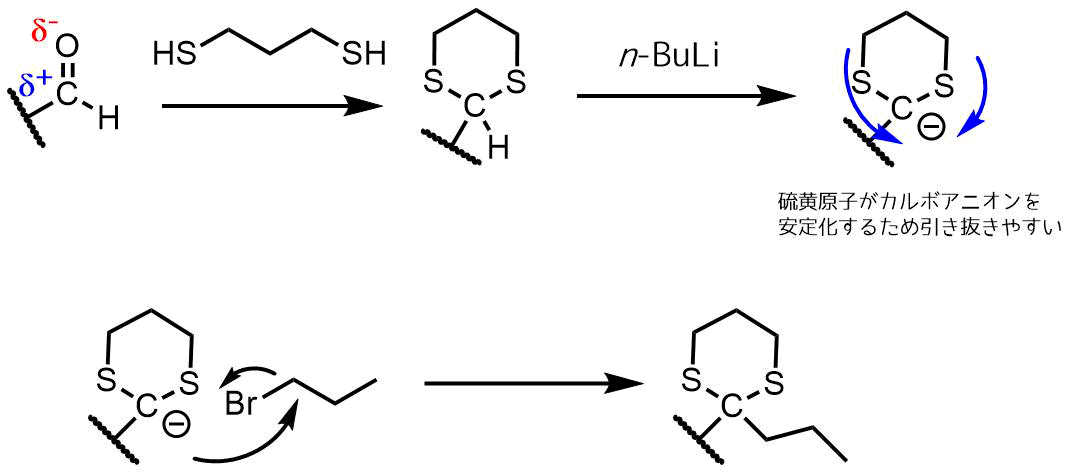
決して化学反応性に乏しいわけではなく、アルデヒドとは異なる反応において、ジチオアセタールの中心炭素は脱プロトン化され求核性を持つ。
と の間の極性の逆転は極性転換と呼ばれる。この反応は1,3-ジチアンを用いて一般的に行われる。リチオ化された中間体は様々な求核的結合形成反応のために使用することができ、次にジチオケタールは加水分解されカルボニル型に戻る。この全体のプロセスはコーリー・ゼーバッハ反応と呼ばれ、アシルアニオンの合成的等価体を与える。
脚注
関連項目
- モジンゴ反応
- チオケタール
![IrelandClaisen転位はケテンシリルアセタールが活躍する[3,3]シグマトロピー転位反応 とらおの有機化学](https://cdn-ak.f.st-hatena.com/images/fotolife/t/tora-organic/20180212/20180212073307.png)