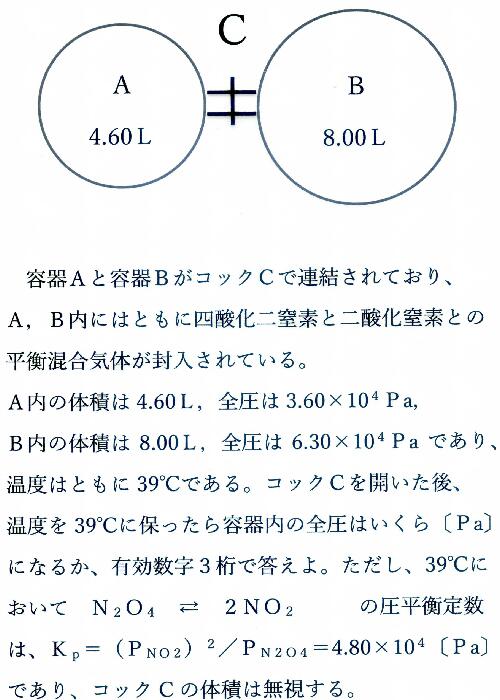
五酸化二窒素(ごさんかにちっそ、dinitrogen pentoxide)とは、化学式が N2O5 と表される窒素酸化物である。硝酸の酸無水物に当たり、無水硝酸(むすいしょうさん)とも呼ばれる。窒素の酸化状態は 5価である。
性質
常圧での融点は 30 ℃、昇華点は 32.4 ℃ である。したがって、常温常圧では固体として存在する。固体は無色で、吸湿性のイオン結晶である。
ただし、それほど安定な化合物ではなく、常圧では45 ℃から50 ℃程度で、二酸化窒素と酸素に分解する。その際の反応式は、次の通りである。
- 2 N2O5 → 4 NO2 O2
反応
五酸化二窒素は水と反応して、硝酸を与える。
クロロホルム溶液は NO2 等価体として、芳香族化合物などのニトロ化に用いられる。
フッ化物イオン F− は、この反応で副生する硝酸を中和する試薬として用いられる場合がある。
また、爆発物を製造する際の原料として検討される場合もある。
危険性
五酸化二窒素は強い酸化剤であり、有機化合物やアンモニウム塩と反応して、爆発性の混合物を作る。
さらに五酸化二窒素が分解しても安全ではない。五酸化二窒素が分解すると、容易に水に溶けて強い酸性を示し粘膜などを侵す、二酸化窒素を生成するためである。ただ、二酸化窒素が生成しても、特徴的な赤褐色の気体であるため、すぐに発見できる。
合成
五酸化二窒素は1840年に、アンリ・ドビーユによって硝酸銀 AgNO3 と塩素 Cl2 から初めて作り出された。
なお、五酸化二窒素は、硝酸の酸無水物であるため、実験室で用いる合成法としては、硝酸 HNO3 を五酸化二リン P4O10 で脱水する方法が比較的簡単である。
構造
固体状態の五酸化二窒素は、直線状の イオンと平面状の イオンに別れた状態で、イオン結晶として存在する。ゆえに硝酸ニトロイルと呼ぶ事もできる。この状態でも窒素原子の酸化状態は共に 5価である。
分子 は固体を昇華して得られる気体、または、四塩化炭素などの溶液中で存在する。気体状態では および の結合角はそれぞれ133度、114度である。気体状の を急速に冷却すると、準安定状態として分子結晶が得られるものの、−70 ℃ 以上では発熱的に反応して上記のイオン構造に変わる。
テトラフルオロホウ酸ニトロイル
五酸化二窒素の反応活性な部分はニトロニウムイオン である。これに対して硝酸イオン は、速度論的に不活性である。すなわち、 をテトラフルオロホウ酸イオン で置き換える方法で、高活性の 源にできる。テトラフルオロホウ酸ニトロイル の利点は、熱的に安定な点である。テトラフルオロホウ酸ニトロイルは、180 ℃ 以上にまで加熱されて初めて、フッ化ニトロイル と三フッ化ホウ素 に分解する。
は様々な有機化合物、特に芳香族化合物や複素環式化合物のニトロ化に利用される。また、フルオロ硫酸などの超酸が作用すると、求電子性がさらに高い化学種である が発生すると考えられている。
出典